Spektroskopi inframerah merupakan suatu metode yang mengamati interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah panjang gelombang 0.75 – 1.000 µm atau pada bilangan gelombang 13.000 – 10 cm-1.
Source : moslemhytech.blogspot.com Metode spektroskopi inframerah merupakan suatu metode yang meliputi teknik serapan (absorption), teknik emisi (emission), teknik fluoresensi (fluorescence). Komponen medan listrik yang banyak berperan dalam spektroskopi umumnya hanya komponen medan listrik seperti dalam fenomena transmisi, pemantulan, pembiasan, dan penyerapan. Penemuan infra merah ditemukan pertama kali oleh William Herschel pada tahun 1800. Penelitian selanjutnya diteruskan oleh Young, Beer, Lambert dan Julius melakukan berbagai penelitian dengan menggunakan spektroskopi inframerah. Pada tahun 1892 Julius menemukan dan membuktikan adanya hubungan antara struktur molekul dengan inframerah dengan ditemukannya gugus metil dalam suatu molekul akan memberikan serapan karakteristik yang tidak dipengaruhi oleh susunan molekulnya. Penyerapan gelombang elektromagnetik dapat menyebabkan terjadinya eksitasi tingkat-tingkat energi dalam molekul. Dapat berupa eksitasi elektronik, vibrasi, atau rotasi. Rumus yang digunakan untuk menghitung besarnya energi yang diserap oleh ikatan pada gugus fungsi adalah:
- E = h.ν = h.C /λ = h.C / v
- E = energi yang diserap
- h = tetapan Planck = 6,626 x 10-34 Joule.det
- v = frekuensi
- C = kecepatan cahaya = 2,998 x 108 m/det
- λ = panjang gelombang
- ν = bilangan gelombang
- a. Daerah infra merah dekat
- b. Daerah infra merah pertengahan
- c. Daerah infra merah jauh
| Jenis | Panjang gelombang | Interaksi | Bilangan gelombang |
|---|---|---|---|
| Sinar gamma | < 10 nm | Emisi Inti | |
| sinar-X | 0,01 - 100 A | Ionisasi Atomik | |
| Ultra ungu (UV) jauh | 10-200 nm | Transisi Elektronik | |
| Ultra ungu (UV) dekat | 200-400 nm | Transisi Elektronik | |
| sinar tampak (spektrum optik) | 400-750 nm | Transisi Elektronik | 25.000 - 13.000 cm-1 |
| Inframerah dekat | 0,75 - 2,5 µm | Interaksi Ikatan | 13.000 - 4.000 cm-1 |
| Inframerah pertengahan | 2,5 - 50 µm | Interaksi Ikatan | 4.000 - 200 cm-1 |
| Inframerah jauh | 50 - 1.000 µm | Interaksi Ikatan | 200 - 10 cm-1 |
| Gelombang mikro | 0,1 - 100 cm | serapan inti | 10 - 0,01 cm-1 |
| Gelombang radio | 1 - 1.000 meter | Serapan Inti |
Metode Spektroskopi inframerah ini dapat digunakan untuk mengidentifikasi suatu senyawa yang belum diketahui,karena spektrum yang dihasilkan spesifik untuk senyawa tersebut. Metode ini banyak digunakan karena:
- a. Cepat dan relatif murah
- b. Dapat digunakan untuk mengidentifikasi gugus fungsional dalam molekul (Tabel 2)
- c. Spektrum inframerah yang dihasilkan oleh suatu senyawa adalah khas dan oleh karena itu dapat menyajikan sebuah fingerprint (sidik jari) untuk senyawa tersebut.
| Gugus | Jenis Senyawa | Daerah Serapan (cm-1) |
|---|---|---|
| C-H | alkana | 2850-2960, 1350-1470 |
| C-H | alkena | 3020-3080, 675-870 |
| C-H | aromatik | 3000-3100, 675-870 |
| C-H | alkuna | 3300 |
| C=C | alkena | 1640-1680 |
| C=C | aromatik (cincin) | 1500-1600 |
| C-O | alkohol, eter, asam karboksilat, ester | 1080-1300 |
| C=O | aldehida, keton, asam karboksilat, ester | 1690-1760 |
| O-H | alkohol, fenol(monomer) | 3610-3640 |
| O-H | alkohol, fenol (ikatan H) | 2000-3600 (lebar) |
| O-H | asam karboksilat | 3000-3600 (lebar) |
| N-H | amina | 3310-3500 |
| C-N | amina | 1180-1360 |
| -NO2 | nitro | 1515-1560, 1345-1385 |
Jenis Vibrasi Molekul
Ada dua jenis vibrasi yaitu:- 1. Vibrasi ulur (Stretching Vibration), yaitu vibrasi yang mengakibatkan perubahan panjang ikatan suatu ikatan
- 2. Vibrasi tekuk (Bending Vibrations), yaitu vibrasi yang mengakibatkan perubahan sudut ikatan antara dua ikatan
- 1. Scissoring
- 2. Rocking
- 3. Wagging
- 4. Twisting
| Symmetrical stretching |
Antisymmetrical stretching |
Scissoring | Rocking | Wagging | Twisting |
|---|---|---|---|---|---|
 |
 |
 |
 |
 |
 |
- 1. Perlu 3 derajat kebebasan untuk translasi
- 2. Perlu 3 derajat kebebasan untuk rotasi
Vibrasi untuk Molekul linier
- 1. Perlu 3 derajat kebebasan untuk translasi
- 2. Perlu 2 derajat kebebasan untuk rotasi (rotasi pada sumbu ikatan tak mungkin)
Contoh : Tentukan vibrasi untuk molekul CO2 Jawab karena CO2 termasuk molekul linier maka vibrasi Penggunaan dan Aplikasi
Spektroskopi inframerah biasanya digunakan untuk penelitian dan digunakan dalam industri yang sederhana dengan teknik yang sederhana dan untuk mengontrol kualitas. Alat spektroskopi inframerah cukup kecil dan mudah dibawa kemana-mana dan kapanpun dapat digunakan. Dengan meningkatnya teknologi komputer memberikan hasil yang lebih baik. Spektroskopi inframerah mempunyai ketepatan yang tinggi pada aplikasi kimia organik dan anorganik. Spektroskopi inframerah juga sukses kegunaannya dalam semikonduktor mikroelektronik[1]: untuk contoh, spektroskopi inframerah dapat digunakan untu semikonduktor seperti Efek isotop
Isotop yang berbeda memberikan bilangan gelombang yang berbeda pada spektroskopi inframerah. Seperti contoh frekuensi regangan O-O memberikan nilai 832 dan 788 cm -1 untuk ν(16O-16O) dan ν(18O-18O) melalui hubungan O-O sebagai sebuah spring, bilangan gelombang,ν dapat dihitung:
 massa dari atom
massa dari atom  ).
).Massa reduksi untuk 16O-16O dan 18O-18O dapat diperkirakan antara 8 dan 9. Sehingga
Daerah Identifikasi
Vibrasi yang digunakan untuk identifikasi adalah vibrasi tekuk, khususnya vibrasi rocking (goyangan), yaitu yang berada di daerah bilangan gelombang 2000 – 400 cm-1. Karena di daerah antara 4000 – 2000 cm-1 merupakan daerah yang khusus yang berguna untuk identifkasi gugus fungsional. Daerah ini menunjukkan absorbsi yang disebabkan oleh vibrasi regangan. Sedangkan daerah antara 2000 – 400 cm-1 seringkali sangat rumit, karena vibrasi regangan maupun bengkokan mengakibatkan absorbsi pada daerah tersebut. Dalam daerah 2000 – 400 cm-1 tiap senyawa organik mempunyai absorbsi yang unik, sehingga daerah tersebut sering juga disebut sebagai daerah sidik jari (fingerprint region). Meskipun pada daerah 4000 – 2000 cm-1 menunjukkan absorbsi yang sama, pada daerah 2000 – 400 cm-1 juga harus menunjukkan pola yang sama sehingga dapat disimpulkan bahwa dua senyawa adalah sama.Persiapan Sampel
Ada berbagai tehnik untuk persiapan sampel, bergantung pada bentuk fisik sampel yang akan dianalisis.- A. Padat
-
- 1. Nujol Mull
-
- 2. Pelet KBr
- B. Cairan
- C. Gas
Penafsiran Spektrum Inframerah
Untuk penafsiran spektrum inframerah tidak ada aturan kaku, namun syarat-syarat tertentu yang harus dipenuhi sebagai upaya untuk menafsirkan suatu spektrum adalah- 1. Spektrum harus terselesaikan dan intensitas cukup memadai
- 2. Spektrum diperoleh dari senyawa murni
- 3. Spektrofotometer harus dikalibrasi sehingga pita yang teramati sesuai dengan frekuensi atau panjang gelombangnya. Kalibrasi dapat dilakukan dengan menggunakan standar yang dapat diandalkan, seperti polistirena film.
- 4. Metode persiapan sampel harus ditentukan. Jika dalam bentuk larutan, maka konsentrasi larutan dan ketebalan sel harus ditunjukkan.[3]
Spektrofotometri Infra Merah
 Spektrofotometri
Infra Red atau Infra Merah merupakan suatu metode yang mengamati
interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah
panjang gelombang 0,75 – 1.000 µm atau pada Bilangan Gelombang 13.000 –
10 cm-1. Radiasi elektromagnetik dikemukakan pertama kali oleh James Clark Maxwell,
yang menyatakan bahwa cahaya secara fisis merupakan gelombang
elektromagnetik, artinya mempunyai vektor listrik dan vektor magnetik
yang keduanya saling tegak lurus dengan arah rambatan.
Spektrofotometri
Infra Red atau Infra Merah merupakan suatu metode yang mengamati
interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah
panjang gelombang 0,75 – 1.000 µm atau pada Bilangan Gelombang 13.000 –
10 cm-1. Radiasi elektromagnetik dikemukakan pertama kali oleh James Clark Maxwell,
yang menyatakan bahwa cahaya secara fisis merupakan gelombang
elektromagnetik, artinya mempunyai vektor listrik dan vektor magnetik
yang keduanya saling tegak lurus dengan arah rambatan.
Gambaran berkas radiasi elektromagnetik diperlihatkan pada Gambar 1 berikut :



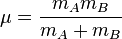

Tidak ada komentar:
Posting Komentar